
المحتوى
- مراحل
- الطريقة الأولى: موازنة معادلة بواسطة طريقة التجربة والخطأ
- الطريقة الثانية: معايرة المعادلة بالطريقة الجبرية
في الكيمياء ، تحدد المعادلة ما حدث أثناء التفاعل الكيميائي. على يسار المعادلة ، نضع الكواشف التي استخدمت للتجربة وعلى اليمين ، المنتجات التي تم الحصول عليها أثناء التجربة. وفقًا لمبدأ الحفاظ على الكتلة (Lavoisier) أثناء التفاعل الكيميائي ، لا تختفي أي ذرة ، ولا يتم إنشاء أي منها ، فهي تتحد بشكل مختلف. باختصار ، يجب أن يكون لديك نفس أرقام البيانات لكل عنصر على اليمين كما في يسار المعادلة. هذا هو السبب في أن معادلة التوازن يجب أن تكون متوازنة دائمًا.
مراحل
الطريقة الأولى: موازنة معادلة بواسطة طريقة التجربة والخطأ
-
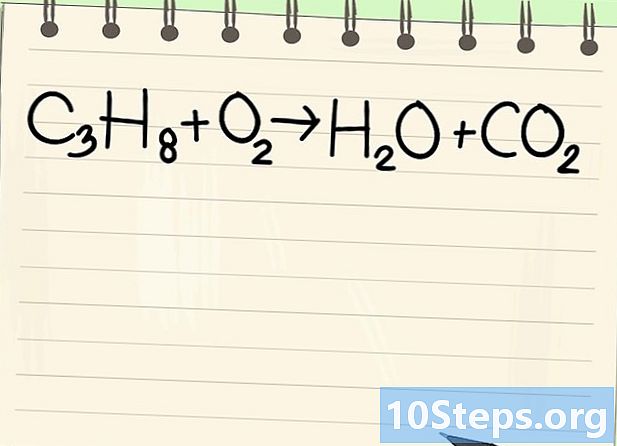
لاحظ معادلة التوازن. سنتعامل مع المعادلة التالية:- C3H8 + يا2 -> ح2O + CO2
- هذه هي معادلة احتراق البروبان (C3H8) في الأكسجين: يتم الحصول على الماء وثاني أكسيد الكربون.
-
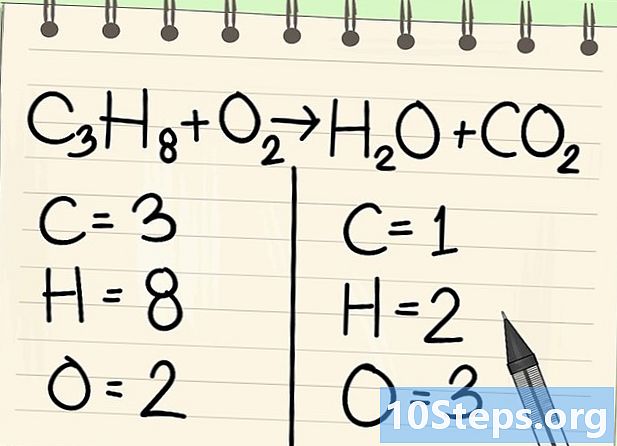
عد الذرات. أدخل عدد بيانات كل عنصر على جانب واحد من المعادلة ، ثم على الجانب الآخر. لهذا ، خذ في الاعتبار المؤشرات ، إذا كان هناك أي ، فإن المؤشر هو 1.- على اليسار ، هناك 3 ذرات كربون و 8 هيدروجين وأوكسجين.
- على اليمين ، هناك ذرة واحدة من الكربون و 2 من الهيدروجين و 3 من الأكسجين.
-
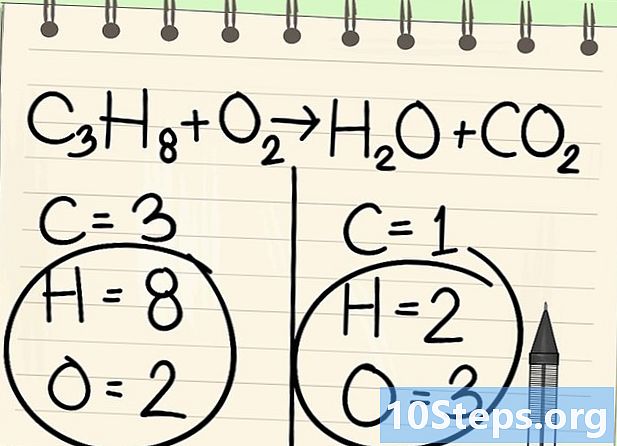
اتركه جانبا مؤقتًا الهيدروجين والأكسجين. -

البدء في تحقيق التوازن مع العنصر الصحيح. نبدأ دائمًا بالجزيء الموجود في الجزيء قبل التفاعل وبعده. إذا كان هناك العديد ، خذ الواحد أحادي التكافؤ في إحدى الجزيئات. هنا نبدأ مع ذرات الكربون. -

موازنة ذرات الكربون. أضف ، على اليمين ، معاملًا لجزيء ثاني أكسيد الكربون (CO2) حيث لاتوم الكربون وحده. سنضع 3 للحصول على 3 ذرات اليسار.- C3H8 + يا2 -> ح2يا 3CO2
- لدينا 3 ذرات كربون على اليمين بفضل المعامل (3CO)2) و 3 ذرات كربون على اليسار بفضل المؤشر (C3H8).
- في المعادلة ، يمكنك وضع جميع المعاملات التي تريدها ، ولكن لا يمكنك لمس القرائن.
-
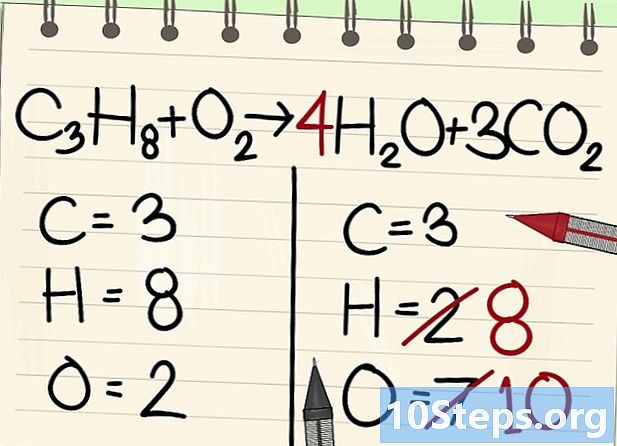
تحقيق التوازن بين ذرات الهيدروجين. نظرًا لأن لديك 8 يسار من المعادلة ، فإنك تحتاج إلى أقصى اليمين.- C3H8 + يا2 --> 4H2يا + 3CO2
- على اليمين ، سوف تضع معامل 4 ، لأن الهيدروجين ثنائي التكافؤ في جزيء الماء: يشير المؤشر 2 إلى أن ذرتين هيدروجين ترتبطان.
- للحصول على عدد ذرات الهيدروجين على اليمين ، تضرب المعامل 4 بالمؤشر 2 أو 8 ذرات.
- بالنسبة لذرات الأكسجين ، على اليمين ، يوجد الآن 6 على جانب واحد ، تأتي من الجزيئات الثلاثة لـ 3CO2 (3 × 2 = 6 ذرات) و 4 من جزيئات 4 من 4 ساعات2O (4 × 1 = 4 ذرات) ، أي ما مجموعه 10 ذرات من الأكسجين.
-
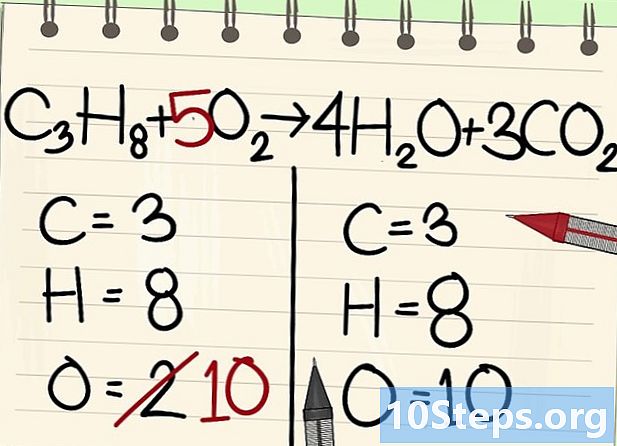
تحقيق التوازن بين ذرات الأكسجين.- بسبب توازن الكربون والهيدروجين ، فإن عدد ذرات الأكسجين ليس هو نفسه على جانبي المعادلة. لقد رأينا سابقًا أن هناك 10 ذرات من الأكسجين على اليمين (4 من جزيئات الماء و 6 من جزيئات ثاني أكسيد الكربون). على اليسار ، هناك فقط 2 (من O2).
- لتحقيق التوازن بين الأكسجين ، أضف معامل 5 إلى جزيء الأكسجين الأيسر: لديك 10 ذرات من الأكسجين على اليسار والآخر على اليمين.
- C3H8 + 5O2 -> 4H2يا + 3CO2
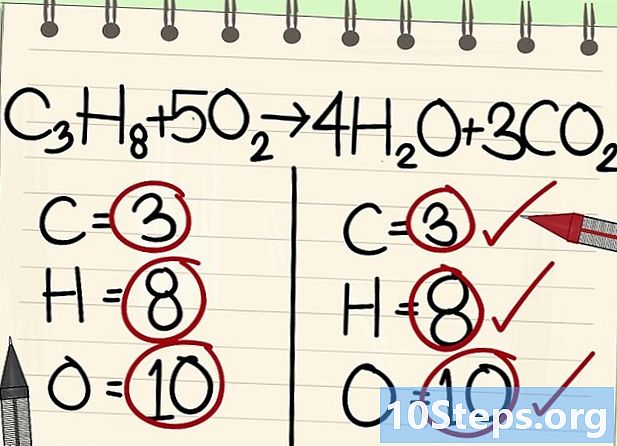
- جميع الذرات (الكربون والهيدروجين والأكسجين) متوازنة: معادلاتك متوازنة.
الطريقة الثانية: معايرة المعادلة بالطريقة الجبرية
-

اكتب المعادلة لتحقيق التوازن. تعيين كل جزيء معامل الحرفي. سوف ندعو لهم الى, ب, ج و د. -
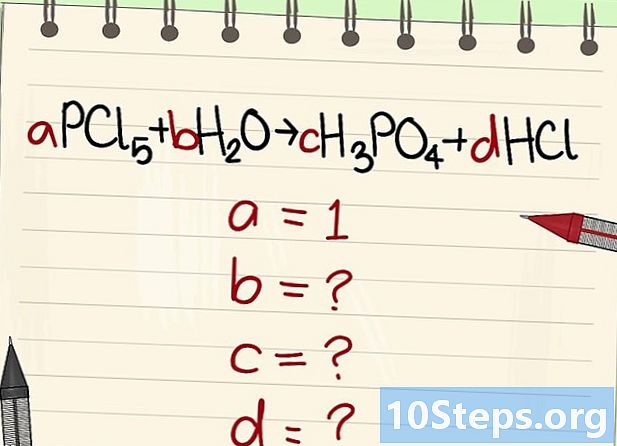
ابحث عن قيمة المعاملات الحرفية الأخرى. سوف نطلب ذلك الى = 1. -

العثور على العلاقات بين هذه المعاملات. بالنظر إلى اليسار (الكواشف) واليمين (المنتجات) ، أنشئ العلاقات بين هذه المعاملات المختلفة.- خذ المعادلة التالية: aPCl5 + bH2O = cH3PO4 + dHCl. وقد ذكر أن = 1 ، مما يعني أن ج = أ ، د = 5 أ و 2 ب = 3 ج + د. تم إجراء الحسابات ، ج = 1 ، د = 5 و ب = 4.

- خذ المعادلة التالية: aPCl5 + bH2O = cH3PO4 + dHCl. وقد ذكر أن = 1 ، مما يعني أن ج = أ ، د = 5 أ و 2 ب = 3 ج + د. تم إجراء الحسابات ، ج = 1 ، د = 5 و ب = 4.


